Silberchlorid, Silberbromid und Silberiodid werden in einer
Ammoniak-Lösung gelöst; die
gesättigte Lösung hat eine
Ammoniak-
Konzentration von 0,1 mol/L. Welche Konzentrationen haben die
Silber-, Chlorid-, Bromid- und Iodid-Ionen?
Lösung:
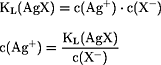
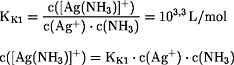
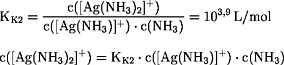
Beim Lösen von
Niederschlägen ist die Anzahl der
Anionen in
Lösung gleich der Anzahl der
Kationen in Lösung:
Beim Auflösen der Silberhalogenide mittels Ammoniak-Lösung werden
mit
NH3
Komplex-Ionen gebildet, die zusammen mit den
Ag+-Ionen den Teil der positiv geladenen Ionen bilden:
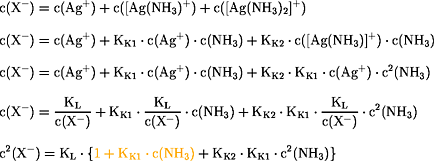
Der erste Teil der Klammer 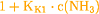 ist
vernachlässigbar
ist
vernachlässigbar
(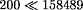 ) gegenüber dem
zweiten Teil der Klammer, so daß sich die Formel vereinfacht:
) gegenüber dem
zweiten Teil der Klammer, so daß sich die Formel vereinfacht:
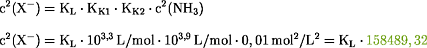
Für KL(AgCl) = 2,0·10-10
mol2/L2 gilt:
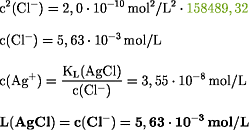
Für KL(AgBr) = 6,3·10-13
mol2/L2 gilt:
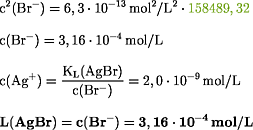
Für KL(AgI) = 1,0·10-16
mol2/L2 gilt:
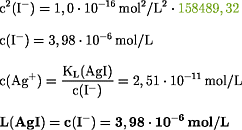
Die
Löslichkeit von Silberiodid in Ammoniak ist zu gering. AgI kann mit
Cyanid-Ionen (CN-) oder Thiosulfat-Ionen
(S2O32-) gelöst werden, weil mit diesen
Ionen die
Komplexbildungskonstanten größer sind (Je
größer die Komplexbildungskonstante, desto leichter bildet sich der
Komplex.). In der Praxis kann deshalb Silberbromid mit konz. Ammoniak und
Silberchlorid bereits mit verd. Ammoniak in Lösung gebracht werden.










