- Anion:
- negativ geladenes Teilchen (Atom oder Molekül)
- Kation:
- positiv geladenes Teilchen (Atom oder Molekül)
- Kathode:
- Elektrode in einer elektrochemischen Zelle
- Halbreaktion an der Elektrode: Reduktion
- Pluspol bei Galvani-Zelle
- Minuspol bei Elektrolyse-Zelle
- Anode:
- Elektrode in einer elektrochemischen Zelle
- Halbreaktion an der Elektrode: Oxidation
- Minuspol bei Galvani-Zelle
- Pluspol bei Elektrolyse-Zelle
- Galvani-Zelle:
- aus der chemischen Energie eines Redoxsystems (Potentialdifferenz
zwischen den Elektroden) wird elektrische Energie (elektrische Spannung)
erzeugt.
Kationen (wandern zur Kathode) nehmen Elektronen auf, Anionen (wandern zur
Anode) geben Elektronen ab.
- Elektromotorische
Kraft (EMK):
- chemische Energie eines Redoxsystems, die durch das Redoxpotential
 E bestimmt wird. Je
größer die Tendenz ist, daß eine chemische Reaktion in
einer Zelle freiwillig abläuft, desto größer ist die
elektromotorische Kraft dieser Zelle E bestimmt wird. Je
größer die Tendenz ist, daß eine chemische Reaktion in
einer Zelle freiwillig abläuft, desto größer ist die
elektromotorische Kraft dieser Zelle
(EMK-Einheit: Volt).
- E0
Standardpotential (Normalpotential):
- Halbzellenpotential der Reduktionsreaktion
(bei Standardbedingungen)
relativ zur Normal-Wasserstoffelektrode, deren Potential E0(H+/H2) = 0 V
willkürlich festgelegt
wurde.
- Elektrochemische
Spannungsreihe:
- Anordnung der Reduktions-Reaktionen nach der Größe des
Standardpotentials:
Je negativer E0, desto stärkeres Reduktionsmittel,
je positiver E0, desto stärkeres Oxidationsmittel.
- Nernstsche
Gleichung:
- beschreibt das Halbzellenpotential in Abhängigkeit von Temperatur
und Konzentration der Reaktanden: Reduktionspotential E (Einheit: Volt)
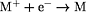
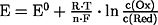
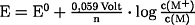
Zusammenhänge:
 G = -n·F·E G = -n·F·E
 G = -R·T·ln K G = -R·T·ln K
-n·F·E = -R·T·ln K
 G ist die freie Reaktionsenthalpie, ein Begriff aus der
Thermodynamik G ist die freie Reaktionsenthalpie, ein Begriff aus der
Thermodynamik
K = Gleichgewichtskonstante einer Reaktion
R = ideale Gaskonstante
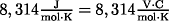
T = Temperatur in Kelvin
F = Faradaysche Konstante
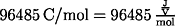
n = Zahl der Elektronen, die vom Reduktionsmittel abgegeben werden
- Redoxpotential
 E: E:
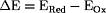
ERed = Halbzellenpotential der Reduktion
EOx = Halbzellenpotential der Oxidation
|












