Rostbildung:

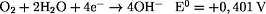
Weiterreaktion:
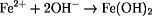
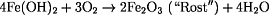
Zinn schützt Eisen vor dem "Rosten", da zuerst der Zinnüberzug
oxidiert wird. Ist die
Zinnhaut nicht mehr intakt, beschleunigt der
Zinnüberzug den Rostvorgang (Zinn ist dann
der elektrische Leiter), da
durch Zutritt von Wasser ein Lokalelement entsteht, bei dem
Eisen (negativeres
Standardreduktionspotential als Zinn) die Anode darstellt.

Lokalelement:
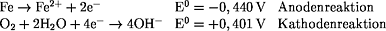
vgl. Eisen mit Zink als Schutzschicht:
Zink (E0 = -0,763 V) ist unedler als Eisen und wird, auch bei
Beschädigung der
Zink-Schutzschicht, zuerst oxidiert.
