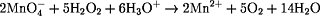Wie lautet die vollständige
Redoxgleichung?
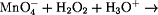
Lösung:
Permanganat ist ein stärkeres
Oxidationsmittel als Wasserstoffperoxid.
Wasserstoffperoxid wird deshalb zu Sauerstoff
oxidiert und
MnO4- zu Mn2+
reduziert (Mn2+ ist
in saurer Lösung besonders stabil gegen Oxidation und Reduktion).
Oxidation:
H2O2: Sauerstoff hat die
Oxidationszahl -1 und
Wasserstoff hat die Oxidationszahl +1.
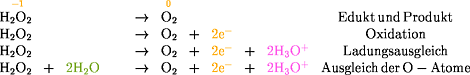
Reduktion:
MnO4-: Sauerstoff hat die Oxidationszahl -2 und Mangan
die Oxidationszahl +7.
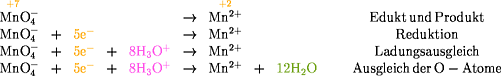
Zum Ausgleich der Elektronenübergänge in den beiden Teilgleichungen
wird der Oxidationsschritt mit Faktor 5 und der Reduktionsschritt mit Faktor 2
multipliziert:
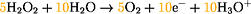
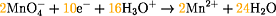
Addition der Teilgleichungen ergibt gesamte Redoxreaktion: