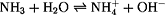
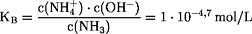
c(NH4+) = c(OH-)
c2(OH-) = KB · c(NH3) = 1·10-4,7 mol/L · 0,1 mol/L
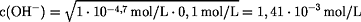
pOH = 2,9
pH = 11,1 (Fällung von M(OH)2 mit kleineren pKL-Werten)
Bei Ammoniumchlorid-Zusatz entsteht ein Puffer:
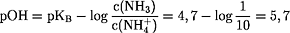
pH = 8,3 (Fällung von M(OH)3 mit größeren pKL-Werten)
Zweiwertige Metallhydroxide werden wegen ihrer größeren KL-Werte im Alkalischen gefällt, bei pH = 11,1 fallen diese daher aus. Entsteht ein Puffer, ist der pH-Wert der Lösung 8,2, d.h. die Lösung ist zu wenig alkalisch, um M(OH)2 auszufällen. Hier werden nun die dreiwertigen Metallhydroxide wegen ihrer kleineren KL-Werte gefällt.
