- pH-Wert:
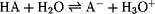
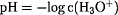
- pH-Wert einer starken Säure: pH =
-log c0(HA)
Eine starke Säure dissoziiert vollständig,
c(H3O+) = c0(HA)
- pH-Wert einer schwachen Säure:
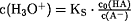
(Wasser ist im Überschuß vorhanden: c(H2O) =
const.)
c(H3O+) = c(A-)
c2(H3O+) =
KS·c0(HA)
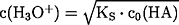
pH = -log c(H3O+)
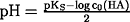
Diese pH-Wert-Berechnung ist nur eine angenäherte Formel, die
für die praktische Anwendung jedoch ausreichend ist, wie folgendes
Beispiel zeigt:
- angenäherte Berechnung:
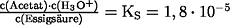
c0(Essigsäure) = 0,1 mol/L
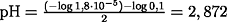
- exakte Berechnung:
c(Essigsäure) = c0(Essigsäure) -
c(H3O+)
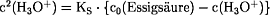
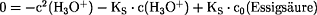
Auflösen der quadratischen Gleichung nach
c(H3O+):
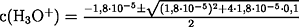
Beim Lösen der quadratischen Gleichung ist nur ein Ergebnis
richtig, da c(H3O+) nicht negativ sein kann:
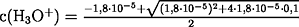
c(H3O+) = 1,332671·10-3 mol
pH = 2,875
- Der Unterschied bei den pH-Wert-Berechnungen macht sich erst bei der
dritten Stelle nach dem Komma bemerkbar, in der Praxis wird aber nur die
erste Stelle nach dem Komma angegeben.
- pOH-Wert:
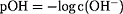
- pOH-Wert einer starken Base: pOH =
-log c0(B-)
Eine starke Base dissoziiert vollständig,
c(OH-) = c0(B-)
- pOH-Wert einer schwachen Base:
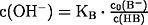
(Wasser ist im Überschuß vorhanden: c(H2O) =
const.)
c(OH-) = c(HB)
c2(OH-) =
KB·c0(B-)
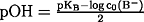
vgl. exakte Berechnung: pH-Wert
- Zusammenhang pH, pOH und Ionenprodukt des Wassers:
- pH + pOH = pKW = 14
- Zusammenhang Säurekonstante und Basenkonstante:
- pKS(Säure) + pKB(konj. Base) = 14
- Pufferlösungen:
- bestehen aus einer schwachen Säure (Base) und einem Salz dieser
Säure (Base). Pufferlösungen halten den pH-Wert weitgehend
konstant, auch wenn in begrenzten Mengen Säure oder Base zugesetzt
werden.
|












