- Avogadrosches Gesetz:
- gleiche Volumina beliebiger Gase haben bei gleichem Druck und gleicher
Temperatur die gleiche Anzahl von Molekülen.
- Vm Molvolumen:
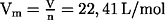
ein mol eines Gases nimmt unter Normalbedingungen ein Volumen von 22,41
Liter ein.
- Normalbedingungen:
-
Normaldruck p = 1 atm = 101,325 kPa = 1013,25 mbar
Normaltemperatur T = 0°C = 273 K
- Standardbedingungen:
-
Standarddruck p = 1 atm = 101,325 kPa = 1013,25 mbar
Standardtemperatur T = 25°C = 298 K
- Ideales
Gasgesetz:
- p·V = n·R·T
p = Druck, V = Volumen
n = Stoffmenge, T = absolute Temperatur (K)
R = Gaskonstante
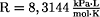
- Boyle-Mariottsches-Gesetz:
- p·V = const, wenn n und T konstant sind
- Gay-Lussacsches-Gesetz:
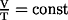 , wenn n und p konstant sind
, wenn n und p konstant sind
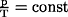 , wenn n und V konstant sind
, wenn n und V konstant sind
|












