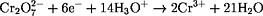
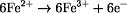
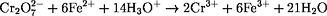
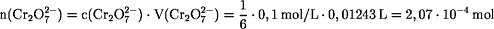
n(Fe2+) = 6 · n(Cr2O72-) = 1,24·10-3 mol
m(Fe2+) = 1,24·10-3 mol · 55,85 g/mol = 0,06925 g (in 100 mL)
In 1000 mL Lösung sind 0,6925 g Eisen(II)-Ionen.
692,5 mg sind 76,54% der Masse des gelösten Eisenoxids; demnach hat
Sauerstoff einen
Massenanteil  von 23,46% in
der Verbindung.
von 23,46% in
der Verbindung.
Berechnung des Stoffmengenverhältnisses Fe:O in der Verbindung:
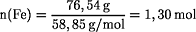
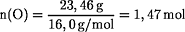
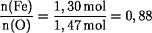
Die Formel für das Eisenoxid ist: Fe0,88O
Dieses Eisenoxid ist eine sog. "nichtstöchiometrische Verbindung".
Die Fe2+-Ionen
werden leicht zu Fe3+-Ionen oxidiert.
Neben Fe2+-Ionen sind deshalb zu einem geringen
Teil
Fe3+-Ionen enthalten; aus Elektroneutralitätsgründen
kommt es zu einem "formalen"
Unterschuß an Eisen.
