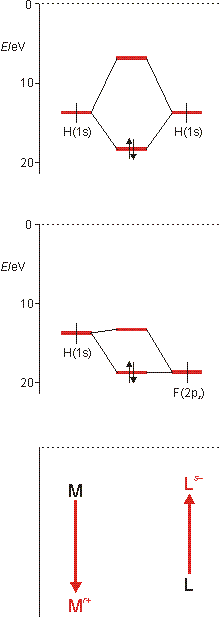
Man beachte bei der Interpretation von MO-Schemata die folgenden Regeln:
- Wechselwirkung zwischen Orbitalen gleicher Energie (obere Abbildung, das H2-Molekül):
- die energetische Aufspaltung zwischen bindendem und antibindendem Orbital ist groß, die Aufenthaltswahrscheinlichkeit des spingekoppelten Elektronenpaars ist an beiden Atomzentren gleich groß; in VB-Schreibweise: H–H.
- Wechselwirkung zwischen Orbitalen verschiedener Energie (mittlere Abbildung, das HF-Molekül, H und F liegen auf der z-Achse des Koordinatiensystems):
- Entsprechend seiner höheren Ionisierungsenergie sind die Orbitalenergien des elektronegativeren Atoms kleiner als die des elektropositiven.
- Die Stabilisierung des bindenden und die Destabilisierung des antibindenden Orbitals fällt deutlich geringer aus als im Fall energiegleicher Orbitale.
- Ein Molekülorbital ist stärker bei dem Atom mit energetisch ähnlicher Lage des Atomorbitals lokalisiert; das besetzte bindende Orbital also an F, das nicht besetzte antibindende Orbital an H; in VB-Schreibweise: H–F ↔ H+ F− oder Hδ+–Fδ−.
- MO-Schemata mit Metall-Ligand-Bindungen (untere Abbildung):
- Sind weder das Metallatom noch der Ligand geladen, dann liegen die Orbitalenergien des (elektropositiven) Metalls über denen der (elektronegativen) Liganden („normales Niveauschema“, engl. normal level scheme); die energetisch tiefliegenden Orbitale sind daher Ligandorbitale, die Grenzorbitale sind dagegen am Metall lokalisiert. Beispiel: [FeII(H2O)6]2+.
- Liegt das Zentralmetall als Kation vor, ändert sich das Schema. Mit höherer Ladung fällt die Entfernung eines Elektrons schwerer, es steigt die Ionisierungsenergie und damit auch die Elektronegativität, die Orbitalenergie ist abgesenkt. Liegt der Ligand als Anion vor, geschieht das Umgekehrte: Elektronen können aus einem Anion leichter entfernt werden, die Orbitalenergie steigt, entsprechend sinken Ionisierungsenergie und Elektronegativität. Bei hoher Oxidationsstufe des Zentralmetalls und anionischem Ligand ist die Reihenfolge der Orbitalenergien umgekehrt wie beim normalen Schema („inverses Niveauschema“, engl. inverted level scheme). Beispiel: [FeIIICl4]−.