 Allgemeine und Anorganische Chemie (AC1)
Allgemeine und Anorganische Chemie (AC1) 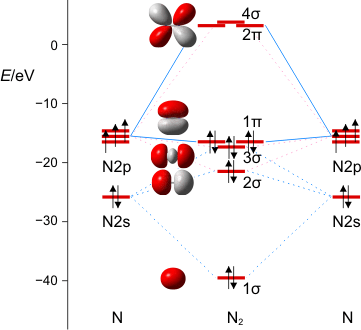
Eine Analyse der σ-Wechselwirkungen könnte vom 2s-Atomobital ausgehen. Durch bindende und antibindende Wechselwirkung mit dem 2s-Orbital des anderen Atoms sollte ein 1σ- und ein 2σ-Orbital entstehen. Die Abbildung zeigt nun das 2σ-Orbital bei einem unerwartet niedrigen Energiewert. Es fällt weiter auf, dass – mit Blick auf die 2s→1σ-Absenkung – die Stabilisierung von 2pz→3σ unerwartet gering ist. Würde man nun ein MO-Schema mit den erwarteten Wechselwirkungen skizieren, würden sich einige Verbindungslinien zwischen Atomorbitalen und den aus ihnen gebildeten Molekülorbitalen überkreuzen. Die Natur vermeidet eine solche Situation. Stattdessen wird in die gedachte reine 2pz-2pz-Wechselwirkung ein so großer 2s-Beitrag beigemischt, dass eine merkliche Destabilisierung eintritt. Zugleich mischt ein so großer 2pz-Anteil in die (gedachte) 2s-2s-Wechselwirkung ein, dass diese so weit stabilisiert wird, dass in der Summe keine Überkreuzung mehr eintritt. (Skizzieren Sie zur Übung die Überlagerungen, die beim 3σ-Orbital zu der im Bild deutlich sichtbaren Verminderung der Überlappung zwischen den Kernen [= Destabilisierung] führt. Beachten Sie ferner eine Besonderheit: durch die s-p-Mischung gerät das 3σ-Orbital energetisch in die Nähe des 1π-Zustandes. Dieser „near-degeneracy“-Fall führt zu Unsicherheiten bei der Berechnung, so dass Sie 3σ in manchen Büchern oberhalb und in anderen unterhalb 1π finden werden.)