 Allgemeine und Anorganische Chemie (AC1)
Allgemeine und Anorganische Chemie (AC1) Die Farbe eines Stoffes beruht in der Regel auf der Anregung eines Elektrons aus dem Grundzustand in ein unbesetztes, energiereicheres Orbital. Die Energiedifferenz wird durch die Absorption von Lichtenergie aufgebracht. Die Energie von Lichtquanten (Photonen) ist der Wellenlänge des Lichtes, also der Farbe, umgekehrt proportional. Absorbiert ein Stoff bei der elektronischen Anregung eine bestimmte Farbe, so nimmt unser Auge die Komplementärfarbe wahr, wenn der Stoff – zum Beispiel dessen Lösung – im Durchlicht (in Transmission) oder in diffuser Reflexion (als feines Pulver) betrachtet wird. Dagegen wird die absorbierte Farbe selbst wahrgenommen, wenn der Stoff unter Spiegelreflexion betrachtet wird (wenn zum Beispiel eine glänzende Kristallfläche betrachtet wird).
Ein Beispiel aus dem Laboralltag: das stark absorbierende Kaliumpermanganat ist in Lösung und als feines Pulver violett; die Flächen von Kaliumpermanganat-Kristallen schimmern dagegen grün.
Chlor ist gelb, da es die Komplementärfarbe blau absorbiert. Blau liegt am energiereichen Rand des sichtbaren Spektrums von 400–800 nm (entsprechend 25.000–12.500 cm−1 in dieser bei Spektren oft abgebildeten Energieeinheit). Übereinstimmend hiermit benötigt die mit niedrigstmöglicher Energie beobachtete Absorption des Chlor-Moleküls ca. 22.000 cm−1. Bei dem mit Arsen in der gleichen Periode stehenden Brom erscheint die Absorption bei etwas niedrigerer Energie.
Die farberzeugende Anregung – hier für Chlor dargestellt – ergibt sich umnittelbar aus dem MO-Schema als Elektronenübergang aus dem höchsten besetzten (HOMO) in das niedrigste unbesetzte Orbital (LUMO). (Techn. Anm.: mp2/6-311+g(2d); rechts ump2, Orbitalenergien über α- und β-Spins gemittelt; bei beiden Zuständen Kern-Kern-Abstand des Grundzustands.)
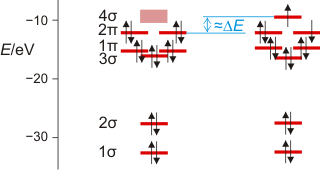
Im linken Teil des Schemas der Grundzustand (man beachte, dass die Energie eines unbesetzten Orbitals in einem Schema, das Elektronenenergien zeigt, nicht ohne Probleme definiert werden kann – daher der verbreiterte Balken), im rechten Teil der angeregte Zustand. Die Energiedifferenz zwischen beiden Zuständen beträgt im Einklang mit der Absorption im Blauen ca. 22.000 cm−1. Näherungsweise entspricht dies dem Energieunterschied zwischen dem HOMO des Grundzustands und dem höchsten halbbesetzten Orbital („SOMO“) des angeregten Zustands (ca. 20.000 cm−1).
Zur Übung: wie ändert sich bei der Anregung die Cl-Cl-Bindungsordnung?
Metallglanz bedeutet, dass vollständige Spiegelreflexion vorliegt, also Spiegelreflexion aller Wellenlängen des sichtbaren Bereichs. Dies bedeutet auch: vollständige Absorption aller Wellenlängen zwischen 400 und 800 nm und nicht nur – wie bei Chlor – eine oder einige wenige passende Orbitalenergiedifferenzen.
Die diffuse Reflexion eines feinen Metallpulvers ist dann über den gesamten sichtbaren Wellenlängenbereich nahe bei Null, das Pulver ist schwarz. (Entspricht es der Alltagserfahrung, das zum Beispiel Silber, mit dem Spiegel beschichtet werden, als Pulver schwarz ist?)