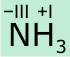 Vorlesung zum Liebig-Lab-Vorkurs
Vorlesung zum Liebig-Lab-Vorkurs
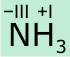 Vorlesung zum Liebig-Lab-Vorkurs
Vorlesung zum Liebig-Lab-Vorkurs
Die begleitende Vorlesung zum Liebig-Laboratorium soll die notwendigen theoretischen Grundlagen vermitteln, die die Teilnehmer des Kurses in die Lage versetzen, alle im Programm vorgesehenen Experimente und Analysen mit Sachkenntnis durchführen zu können. Der Hauptschwerpunkt liegt dabei auf der Vermittlung von Fähigkeiten und Fertigkeiten bei der Bearbeitung der drei Kapitel des Liebiglabs (Kalkkreislauf, Aminosäuren, Redoxchemie von Peroxiden). Einen weiteren Schwerpunkt der Vorlesung bildet die Vermittlung von wichtigen Grundkenntnissen der chemischen Maßanalyse (Komplexometrie, Säure-Base-Chemie von Ampholyten/Aminosäuren, Redoxtitrationen), um die handwerklichen Grundlagen für die Durchführung von analytischen Methoden im Liebig-Laboratorium gewährleisten zu können.
Die begleitende Vorlesung zum Vorkurs wird von Herrn PD Dr. Böttcher in der Zeit vom 5. September bis 23. September 2011 jeweils von 10.00 bis 12.00 im Hörsaal 3 des Klinikums, später im Liebig-HS gehalten. Die Abschlussklausur zum Vorkurs findet am 23. September 2011 von 10.00 bis 11.30 Uhr im Liebig-HS statt. Für das Schreiben der Klausur ist es notwendig, dass Sie einen (nichtprogrammierbaren) Taschenrechner mitbringen. Alle anderen Materialien werden Ihnen zur Verfügung gestellt.
Als begleitendes Lehrbuch empfehlen wir Ihnen das Werk C. E. Mortimer, U. Müller: Chemie. 9. Auflage, Thieme 2007, ISBN 978-3-13-484309-5. Der „Mortimer“ steht Ihnen auch innerhalb des Münchner Hochschulnetzes elektronisch zur Verfügung: „E-Book“
Die Seitenangaben in diesem Skript beziehen sich eben auf diese Ausgabe.
Wenn Sie den Text dieses Skriptes auszudrucken möchten, können Sie natürlich Ihren Browser verwenden oder aber diese pdf-Datei.
Die Lernziele dieser Lehreinheit umfassen folgende Schwerpunkte: Sicherer Umgang mit Reaktionsgleichungen und den Gesetzmäßigkeiten zu Masse- und Volumenverhältnissen bei chemischen Reaktionen (Gesetz von der Erhaltung der Masse, Gesetz der konstanten Proportionen, Gesetz der multiplen Proportionen). Am Ende der Lehreinheit sollten Sie sicher mit den üblichen Größen und Konzentrationsmaßen der Chemie umgehen können (Molare Masse, Massenanteil, Stoffmengenkonzentration, Äquivalentkonzentration, Rechnen in der Maßanalyse/Volumetrie, Aufstellen von Summenformeln aus gefundenen Daten der Elementaranalyse, Berechnung von Mischungsverhältnissen/Mischungskreuz).
Literatur: „Mortimer“ S. 2–14, S. 25–33, S. 35–42 und S. 144–160.
Literatur: AC1–Skript (Prof. Klüfers) Teil A, pdf-Version S. 5–15, S. 19–20.
Wir definieren den Begriff des Mols als einer der 7 Grundeinheiten des SI-Systems. Es handelt sich dabei um eine definierte Objektmenge von Teilchen (Avogadro-Konstante), die gleichwertig auf Atome, Moleküle, Ionen, Elektronen oder auch Formeleinheiten angewendet wird.
In diesem Kapitel lernen Sie wichtige Gesetze zu den Massebilanzen chemischer Reaktionen kennen (Masseerhaltung, Gesetz der konstanten und multiplen Proportionen, Gleichung des idealen Gases). Wir definieren folgende Begriffe: relative Atommasse (Berücksichtigung der natürlichen Isotopenverteilung), molare Masse, Stoffmengenkonzentration, Massenanteil, Äquivalent (Neutralisationsreaktion, Redoxäquivalent, Ionenäquivalent), Äquivalentkonzentration und molares Normvolumen. In diesem Zusammenhang werden zahlreiche Rechenbeispiele für alle besprochenen Kenngrößen geübt.
Im Hinblick auf die Stoffmengenkonzentration („Molarität“, Begriff eigentlich veraltet, aber im Laborbetrieb immer noch verwendet!) und Äquivalentkonzentration („Normalität“) lernen Sie den wichtigen Begriff des Urtiters kennen, der für die Maßanalyse (Volumetrie) von entscheidender Bedeutung ist. Wir besprechen ausführlich die wichtigsten Grundprinzipien der Darstellung von Maßlösungen und deren sachgemäßen Umgang (Handhabung von Glasgeräten der Maßanalytik). Für die Arbeit im chemischen Laboratorium ist es häufig notwendig, dass Verdünnungsreihen aus einer zur Verfügung stehenden Standardlösung ausgeführt werden müssen. Vergleichen Sie dazu auch den Versuch „Konzentrationsreihe“ im Kapitel „Handwerkszeug für die Laborarbeit“ des Praktikumsskriptes für den Liebig-Lab-Vorkurs. In diesem Zusammenhang lernen Sie die Berechnung von Mischungsverhältnissen kennen (sog. „Mischungskreuz“). Wir üben Beispiele zur Berechnung von Mischungsverhältnissen für die Kenngrößen Molarität, Normalität, Massenanteil (Masseprozent [Begriff veraltet]) und Volumenanteil (Volumenprozent [veraltet]). Danach sollten Sie in der Lage sein, selbst Verdünnungsreihen herzustellen.
Sie sollen beim Blick auf das Periodensystem der Elemente (PSE) bezüglich der Stellung eines konkreten Elements erkennen können, in welchen Oxidationszahlen das jeweilige Element in seinen Verbindungen auftreten kann (und in welchen mit Sicherheit nicht!). Dazu verständigen wir uns in sehr gestraffter Form über den Atombau der Elemente mit dem Ziel, dass Sie sich ableiten können, wieviele Valenzelektronen jeweils die Atome eines betrachteten Elements aufweisen. Für das Ermitteln von formalen Oxidationszahlen ist es weiterhin unbedingt erforderlich, den Begriff der Elektronegativität einzuführen. Die Grundlage hierfür ist, in kurzer Form die Periodizität einiger (physikalischer) Eigenschaften der Elemente des PSE zu beleuchten.
Literatur: „Mortimer“ S. 16–24, S. 81–86, S. 90–105 und S. 112–114.
Literatur: AC1–Skript (Prof. Klüfers) Teil A, pdf-Version S. 26–27, S. 54–57.
Wir besprechen in sehr kurzer Form den Bau der Atome und das daraus abgeleitete Ordnungsprinzip im PSE (Kernladungszahl = Ordnungszahl). Es wird auf das sogenannte Kurzperiodensystem verwiesen, wobei es sich für viele Zwecke jedoch als zweckmäßiger erweist, das Langperiodensystem zu nutzen. Mit Hilfe des letzteren ist es einfacher, Ableitungen über den Atombau zu treffen (aktuelle Gruppennummerierung durch die IUPAC: Gruppe 1 bis 18). Wir gehen kurz auf die Begriffe Elektronenaffinität und Ionisierungspotential ein, da diese beiden Größen zum relativen Maß der Elektronegativität eines jeweiligen Elements beitragen. Es wird ein Überblick über den Gang der relativen Elektronegativitätswerte der Elemente innerhalb des PSE gegeben.
Wir besprechen den Begriff der Valenz (Wertigkeit) als Fähigkeit eines gegebenen Atoms, mit einer bestimmten Anzahl anderer Atome eine Verbindung einzugehen. Es werden drei Haupttypen der chemischen Bindung (Atombindung/kovalente Bindung; Ionenbindung/Ionenbeziehung; metallische Bindung) erwähnt, ohne diese näher zu definieren und zu besprechen. Lediglich soll eine grobe Abschätzung zum Bindungstyp aus den Elektronegativitätswerten der beteiligten Atomsorten in der Formel einer konkreten Verbindung vorgenommen werden.
Nach Behandlung dieser Lehreinheit sollten Sie die chemischen Hintergründe aller zu behandelten Reaktionen des Abschnittes „Gefahrstoffe“ des Vorpraktikumskurses verstanden haben und somit in der Lage sein, entsprechende Reaktionsgleichungen für zahlreiche Redoxvorgänge zu formulieren.
Literatur: „Mortimer“ S. 229–234 und S. 358–363.
Literatur: AC1–Skript (Prof. Klüfers) Teil A, pdf-Version S. 112–116.
Wir definieren zunächst den Begriff der Oxidationszahl und besprechen die wichtigsten Regeln zum Aufstellen von Oxidationszahlen. In diesem Zusammenhang werden neben wichtigen anorganischen Verbindungstypen (ausführlich am Beispiel des Elements Stickstoff in all seinen üblichen Oxidationsstufen) auch die Regeln besprochen, die auf Verbindungen des Kohlenstoffs in der organischen Chemie angewendet werden. Auf den Umstand, dass das Redoxverhalten der meisten Verbindungen hauptsächlich durch die Stellung in der elektrochemischen Spannungsreihe bestimmt wird, wird zunächst nur am Rande eingegangen.
Wir lernen die Teilvorgänge Oxidation und Reduktion kennen und besprechen ausführlich, wie an das Aufstellen von vollständigen Redoxgleichungen heranzugehen ist. In diesem Zusammenhang wird zunächst der Gefahrstoff konzentrierte Salzsäure besprochen. Unedle Metalle lösen sich beim Kontakt mit der Säure rasch unter Wasserstoffentwicklung auf, was an einigen Beispielen demonstriert wird. Wesentlich problematischer gestaltet sich der Kontakt von konzentrierter Salzsäure mit stark oxidierenden Substanzen wie Alkalichromaten, Kaliumpermanganat oder Kaliumchlorat. Wir diskutieren in diesem Zusammenhang einige wichtige Reaktionen, die ein beträchtliches Gefahrenpotential aufweisen.
Wegen der erhöhten Explosionsgefahr führen Sie im Praktikum keine Versuche zur Reaktion von Metallhydriden mit protonenaktiven Säuren durch; wir werden aber in diesem Zusammenhang Reaktionen theoretisch besprechen.
Konzentrierte Schwefelsäure besitzt einerseits die hohe Neigung, organischen Materialien durch chemische Reaktion letzendlich Wasser zu entziehen. Außerdem erweist sich die konzentrierte Säure als stark oxidierende Substanz; wir besprechen in diesem Zusammenhang zahlreiche Reaktionen. Im Gegensatz zur Schwefelsäure (in Flaschen abgefüllt prinzipiell unbegrenzt haltbar) ist die Schweflige Säure sehr unbeständig (nur in Form von Salzen in Flaschen abfüllbar und haltbar). Somit zeigt sich schon eine gewisse Redoxaktivität: aufgrund der leichten Oxidierbarkeit zum Sulfat wirken in der Regel die Säure bzw. deren Salze als gute Reduktionsmittel, wie wir an einigen Beispielen diskutieren werden.
Einen weiteren potentiellen Gefahrstoff stellt konzentrierte Salpetersäure dar. Wir besprechen Reaktionen dieser Säure unterschiedlicher Konzentration mit zahlreichen Metallen: wir werden sehen, dass sich eine vielfältige Chemie in diesem Umfeld eröffnet. Durch Variation des pH-Wertes in den basischen Bereich werden erstaunliche Reaktionen am Nitration beobachtet: Stickstoff kann dabei von seiner höchsten formalen Oxidationsstufe in seine niedrigste übergehen, es handelt sich hierbei um einen Achtelektronenübergang. Ein Vorgang dieser Art wird selten beobachtet, beispielsweise auch bei der Reduktion von Rutheniumtetraoxid zu metallischem Ruthenium in Gegenwart von organischem Material. Letztere Reaktion verläuft in aller Regel explosionsartig!
Beim Kennenlernen der Reaktivitätsmuster der Salpetersäure besprechen wir auch Wege zur Darstellung von Stickstoffmonoxid, ein Molekül, dem unter anderen eine besondere Bedeutung in biochemischen Prozessen zukommt. Andererseits ist der technische Prozess der Oxidation von Ammoniak zu NO für die chemische Industrie von immenser Bedeutung. In diesem Zusammenhang werden die wichtigsten Reaktionen von Ammoniak besprochen.
Bedeutende Basen in Labor und Technik sind Natron- und Kalilauge, wobei der Umgang mit diesen Lösungen ebenfalls ein erhöhtes Gefahrenpotential darstellt. Wir lernen zum einen Reaktionen aus dem Bereich der Redoxchemie kennen (in Gegenwart unedler Metalle wird auch hier Wasserstoff freigesetzt, Explosionsgefahr!); zum anderen diskutieren wir Reaktionen mit Protonenübergang, die nicht als Redoxvorgänge zu klassifizieren sind. Den Abschluss des Kapitels über Redoxreaktionen bildet die Behandlung der Chemie der (unter anderem redoxamphoteren) Verbindung Wasserstoffperoxid.
Im zweiten Semester ihres Studiums werden Sie kennenlernen, wie die Kationen komplexer Salzgemische durch spezielle Trennungsgänge getrennt werden. Vor deren Ausführung ist es wichtig zu wissen, welche Anionen im zu analysierenden Salzgemisch vorliegen, da sie sich unter anderem störend auf den systematischen Gang der Kationentrennung auswirken können. Im Rahmen des Vorpraktikums erwerben Sie Kenntnisse und Fertigkeiten, um einfache Anionen (Chlorid, Bromid, Iodid, Sulfat, Carbonat, Nitrat/Nitrit, Phosphat und Acetat) nachweisen zu können.
Literatur: „Mortimer“ S. 59–65 und S. 320-329.
Literatur: AC1–Skript (Prof. Klüfers) Teil A, pdf-Version S. 85–87.
Die Basis für den qualitativen und quantitativen Nachweis der meisten Anionen ist häufig durch die unterschiedliche Löslichkeit von Salzen gegeben. In diesem Zusammenhang verständigen wir uns zu den Begriffen der Löslichkeit und des Löslichkeitsproduktes, die die Grundlage für den analytischen Nachweis der Halogenid-Ionen sowie der Anionen Sulfat, Carbonat und Phosphat bilden. Zum Verständnis des analytischen Nachweises von Nitrat-Ionen ist es zweckmäßig, kurz auf die Bildung und die Zusammensetzung von Komplexverbindungen in wässriger Lösung einzugehen. Für den Nachweis von Carbonat oder Acetat ist es einerseits erforderlich, die Prinzipien chemischer Reaktionen im Zusammenhang mit dem Massenwirkungsgesetz zu kennen. Andererseits sind für diese Nachweisreaktionen Kenntnisse zur Stärke von Säuren (und Basen) erforderlich. Hier ergibt sich eine unmittelbar enge Verknüpfung zum Stoff des nachfolgenden Kapitels.
Am Ende des vorherigen Kapitels waren wir auf ein Problem gestoßen: wie kann abgeschätzt werden, ob in einem Salz das Anion einer starken oder schwachen Säure vorliegt? Eine andere wichtige Frage in diesem Zusamenhang ist: welche Kriterien gibt es, um die Stärke von Säuren und Basen einzustufen? Um diese Fragen beantworten zu können, verständigen wir uns im Rahmen der Säure-Base-Theorie nach Broensted zu den Grundlagen von Säure-Base-Gleichgewichten. Nachdem Sie schon in Kapitel 1 die theoretischen Grundlagen zur Maßanalyse kennengelernt haben, sollen Sie nun Fähigkeiten und Fertigkeiten in der praktischen Umsetzung einer quantitativen Maßanalyse (Gehaltsbestimmung einer Salzsäure) erwerben.
Literatur: „Mortimer“ S. 40–41, S. 282-287 und S. 294-315.
Literatur: AC1–Skript (Prof. Klüfers) Teil A, pdf-Version S. 74–76, S. 88–108.
Wir definieren die Stärke von Säuren und Basen und leiten an einfachen Beispielen Regeln zum Zusammenhang von Säurestärke und Molekülstruktur ab. Auch bei der Betrachtung der Basestärke können aus der Stellung der Elemente im PSE Regeln erkannt werden, die zu besprechen sind. In Vorbereitung auf die Durchführung von Säure-Base-Titrationen behandeln wir folgende Schwerpunkte: Ionenprodukt des Wassers, Definition des pH-Wertes, starke und schwache Elektrolyte, Stoffe und Methoden (pH-Meter) zur Indikation des pH-Wertes, Pufferlösungen und deren Wirkung, Titration einer starken Säure mit einer starken Base. In diesem Zusammenhang werden viele Rechenbeispiele behandelt: dazu sollten Sie stets einen Taschenrechner dabei haben und sich gut im Umgang mit den Gesetzen zu Logarithmen auskennen. Sollte Zeit bleiben, besprechen wir noch Titrationskurven bei Variation der Säure- und Basestärke der Reaktionspartner. Diese Fälle sind jedoch für die Arbeiten im Vorpraktikumskurs zunächst nicht von Belang.
In Vorbereitung auf die auszuführende alkalimetrische Bestimmung einer Salzsäure lernen Sie zunächst die Herstellung einer NaOH-Maßlösung kennen. Werden Maßlösungen selbst bereitet, ist es erforderlich, eine sogenannte Faktorbestimmung vorzunehmen. (Es hat sich allerdings in der Praxis auch sehr bewährt, kommerziell erworbene Maßlösungen regelmäßig zu überprüfen!) Wir besprechen das Prinzip der Titration der von Ihnen selbst bereiteten NaOH-Lösung mit einer Maßlösung bekannten Titers, den wir in diesem Fall als Urtitersubstanz definieren. Somit sollten Sie in der Lage sein, die Gehaltsbestimmung der an Sie ausgegebenen Säure selbstständig vornehmen zu können.